休眠をもたらす遺伝子の探索
-休眠中の筋肉に起こる遺伝子発現変化を網羅的に解析-
理化学研究所(理研)生命機能科学研究センター網膜再生医療研究開発プロジェクトの砂川玄志郎上級研究員、生命医科学研究センタートランスクリプトーム研究チームのオレグ・グセフ客員主管研究員らの国際共同研究グループは、過酷な環境に置かれた哺乳類が自ら代謝を下げて生存を図る「休眠[1]」に関わる遺伝子を探索し、転写因子Atf3[2]がマウスの「日内休眠[1]」に重要な役割を果たすことを発見しました。
本研究成果から、休眠研究のモデル動物としてマウスが有用であることが示されました。今後さらに休眠メカニズムの解析を進めることで、日内休眠や長期の休眠現象である冬眠[1]を人工的に誘導する技術への応用が期待できます。
寒冷期や飢餓などの環境下で、一部の哺乳類は、自ら代謝を下げることでエネルギー消費を抑える「能動的低代謝」を行って生き延びようとします。この現象を休眠と呼び、数カ月に及ぶ休眠を「冬眠」、数時間の休眠を日内休眠と呼びます。
今回、国際共同研究グループは、休眠中の不動状態でも機能低下しない筋肉に着目し、マウスの骨格筋で働く遺伝子の中から休眠特異的遺伝子を同定しました。中でも、転写因子Atf3をコードする遺伝子は休眠の早期に発現が上昇し、他の休眠特異的遺伝子の発現を制御している可能性が示されました。さらに、Atf3遺伝子を破壊すると休眠の表現型に変化が見られたことから、Atf3が休眠の制御に関与していることが示されました。
本研究は、科学雑誌『Communications Biology』(11月15日号)に掲載されました。
二つの条件で誘導される休眠時の体温低下は、Atf3遺伝子の機能を必要とする
背景
ヒトを含む哺乳類は、環境の温度が変化しても体温を一定に保てます。これは、食事と呼吸で得たエネルギー源と酸素を、代謝により熱に変えることができるからです。一方、寒冷期や飢餓などの危機的な環境下で、一部の哺乳類は、自ら代謝を下げることでエネルギー消費を抑える「能動的低代謝」を行って生き延びようとします。この現象を「休眠」と呼び、数カ月に及ぶ休眠を「冬眠」、数時間の休眠を「日内休眠」と呼びます。
休眠中の動物は酸素消費量が正常の1~30%程度まで低下し、結果として環境温度より数℃高い程度の体温まで低下します。しかしヒトのように低温障害や凍傷になることはなく、内臓などの器官にも特に異常は生じません。このような低代謝耐性・低体温耐性の原理は分かっておらず、冬眠動物を用いて解明が試みられていますが、研究のために人為的に冬眠させることの難しさや、遺伝学的手法の多くが適用できないことなどにより、十分な成果が得られていません。
哺乳類のモデル動物として確立しているマウスは、冬眠はしませんが、飢餓状態で日内休眠を行うことが知られています。そこで国際共同研究グループは、マウスを用いて休眠に特異的な遺伝子発現を詳細に調べるため、骨格筋を対象に研究を進めました。休眠中の動物に特異的な現象として、長時間にわたってほぼ動かないにもかかわらず、筋肉の衰え(萎縮)がほとんど起きないことが知られているからです。
研究手法と成果
マウスは24時間絶食すると、日内休眠を誘導できます。特にC57BL/6J[3]という系統の個体は、20℃の環境温度で再現よく休眠を誘導できます(図1)。
図1 マウスの絶食による日内休眠の誘導
マウスは、明期(照明下の12時間)の開始から24時間絶食すると、暗期(無照明下の12時間)の後半に自ら代謝を低下させて体温が低下する(図中の矢印)。この状態を日内休眠と呼び、再現よく休眠を誘導できる方法として確立されている。
休眠特異的遺伝子を見つける手掛かりとして、まず、日内休眠の間にだけ発現が変化し、前後では発現量が変化しない「休眠可逆性遺伝子」を探索しました(図2)。探索の手法には、特定の細胞でどの遺伝子が発現しているかだけではなく、遺伝子のどの配列から転写が始まるか(転写開始点)まで正確に把握できるCAGE法[4]を用いました。その結果、骨格筋の細胞で休眠中のみ遺伝子発現が上昇した遺伝子を589個、低下した遺伝子を277個検出しました。
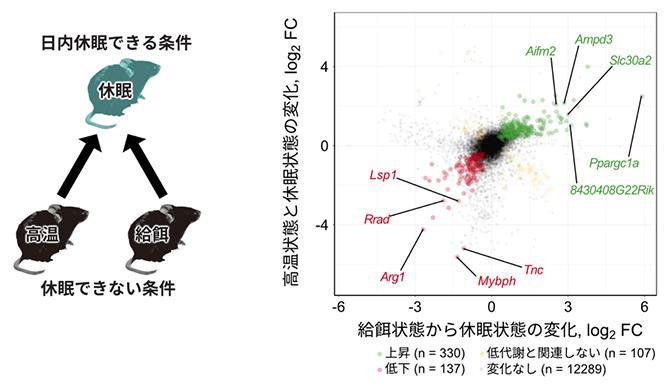
図2 休眠可逆性遺伝子の探索
日内休眠は、特定の環境温度と絶食がそろうことで誘導されます。従って、それぞれの条件を取り除くと、高温のため休眠できない状態や、餌があるために休眠できない状態になります。これらの休眠阻害状態と、休眠を誘導した場合の遺伝子発現を比較することで、絶食状態や低温環境のみに反応した遺伝子と、低代謝状態のみに反応した遺伝子を区別できます。比較の結果、低代謝特異的に発現が上昇する遺伝子を330個、発現が低下する遺伝子を137個検出し、これらを日内休眠の低代謝状態に特異的な「低代謝関連遺伝子」と名付けました(図3)。
図3 低代謝関連遺伝子の探索
次に、休眠可逆性遺伝子と低代謝関連遺伝子の両条件を満たす遺伝子を「休眠特異的遺伝子」と定義しました(図4)。休眠特異的遺伝子では、休眠中に上昇する遺伝子が226個、低下する遺伝子が61個見つかりました。さらに、それぞれの遺伝子の転写開始点を正確に調べたところ、休眠中に発現が低下する遺伝子は、特定の配列から転写が始まる傾向が他の遺伝子に比べて強いことが分かりました。遺伝子は一般的に複数の転写開始点を持ち、細胞の状態によって転写開始点を使い分けることが知られています。このことから、低代謝状態の筋細胞では、遺伝子の転写状況に大きな変化が起きている可能性が示されました。
図4 休眠特異的遺伝子の探索
休眠特異的遺伝子は、休眠中に骨格筋で発現が変化する遺伝子群です。この中には、休眠シグナルを受け取る役割や、その結果筋肉の性質を変える役割など、筋細胞の遺伝子発現ネットワークの上流から下流までのさまざまな位置にある遺伝子が含まれています。筋肉に休眠をもたらす遺伝子は、このネットワークの上流に位置し、その発現変化は下流遺伝子よりも早期に現れるはずです。このような上流遺伝子を同定するためには、完全な休眠に入る直前に既に高く発現し始める遺伝子を見つけることが重要だと考えられます。
このような状況を作り出すため、休眠に入りそうになったときに優しく触れることでマウスの体に刺激を与え、休眠したくてもできない「断休眠状態」を作り出し、骨格筋の遺伝子発現を調べました(図5)。その結果、完全な休眠状態にある骨格筋と比較して、45個の遺伝子が上昇し、27個の遺伝子が低下していることが分かりました。この遺伝子の中から、転写因子Atf3をコードするAtf3遺伝子に着目しました。Atf3遺伝子は休眠特異的遺伝子にも属しており、さらに、多くの休眠特異的遺伝子のプロモーター[5]領域には、転写因子Atf3の結合配列が含まれていることが分かりました。これは、休眠に入る際にまずAtf3遺伝子の発現が上昇し、多量に作られた転写因子Atf3が標的遺伝子のプロモーターに結合してそれらの発現を活性化、もしくは抑制することを意味しています。
図5 断休眠による休眠圧の高い状態の遺伝子発現を探索
マウスの体を直接触ることで休眠を妨げ、実際に休眠したくてもできない状態を作り出した。この断休眠状態と休眠しているときの骨格筋の遺伝子発現を比較した。断休眠中に発現が強い遺伝子(緑点)と、弱い遺伝子(赤点)を示す。
そこで、Atf3遺伝子の機能を調べるため、Atf3遺伝子を破壊したマウス(Atf3-ノックアウトマウス)を作製し、日内休眠の表現型を解析しました。その結果、Atf3-ノックアウトマウスは休眠できましたが、そのときの低代謝状態は、正常マウスに比べて穏やかな変化であることを確認しました。このことから、Atf3は筋肉だけではなく、個体レベルで休眠現象の制御に関与している転写因子であることが示されました。
図6 Atf3遺伝子破壊による絶食性休眠のマウス表現型の変化
Atf3遺伝子を破壊したマウス(Atf3-KO)の絶食性休眠の表現型を評価したところ、Atf3-KOでは休眠中の代謝低下が野生型マウスに比べて弱い傾向が見られた。淡色の線は実際の測定データを表し、濃色の線は各グループの特定時点での中央値を表している。▲給餌中止、△給餌再開。
今後の期待
今回の研究により、実験的に誘導できるマウスの日内休眠は、休眠メカニズムの研究に極めて強力な実験系であることが分かりました。今後は、筋肉以外のさまざまな臓器に対して同様のアプローチをとり、より普遍的な休眠制御遺伝子を探索することが重要となります。
さらに、絶食性休眠よりも冬眠に近い冬眠様状態のマウスを調べることも重要です。国際共同研究グループの砂川上級研究員らは2020年に、脳の特定の神経細胞を刺激することで、環境温度や絶食条件なしでもマウスやラットを24時間位以上の休眠状態(冬眠様状態)にできることを報告しています注1)。これらの知見に基づいて、将来はヒトの細胞や組織を休眠状態にするための分子メカニズムを探求します。ヒトで人工的な休眠誘導が実現すれば、組織や臓器を対外で長期保存する技術や、外傷や疾患により障害を受けた部位の症状の悪化を遅らせる治療法への応用など、医療分野への応用も期待できます。
補足説明
国際共同研究グループ
理化学研究所生命機能科学研究センター網膜再生医療研究開発プロジェクト上級研究員 砂川 玄志郎(すながわ げんしろう)テクニカルスタッフ 石川 清美(いしかわ きよみ)客員主管研究員 髙橋 政代(たかはし まさよ)生体モデル開発チームチームリーダー 清成 寛(きよなり ひろし)技師 阿部 高也(あべ たかや)生命医科学研究センタートランスクリプトーム研究チーム客員主管研究員 オレグ・グセフ(Oleg Gusev)(カザン連邦大学 制御ゲノミクス研究センター センター長)
カザン連邦 大学制御ゲノミクス研究センター研究員 ラスラン・デビアチアロフ(Ruslan Deviatiiarov)研究員 グゼル・ガジゾバ(Guzel Gazizova)
研究支援
本研究は、理化学研究所運営費交付金(生命機能科学研究)で実施し、一部は、基礎科学特別研究員制度(砂川玄志郎)、日本学術振興会(JSPS)科学研究費補助金新学術領域研究(研究領域提案型)「近交系マウスを用いた低体温メカニズムの解明(研究代表者:砂川玄志郎)」、同基盤研究(A)「哺乳類の低代謝機構を応用した革新的組織保存法の開発(研究代表者:高橋政代)」による支援を受けて行われました。
原論文情報
発表者
理化学研究所生命機能科学研究センター 網膜再生医療研究開発プロジェクト上級研究員 砂川 玄志郎(すながわ げんしろう)生命医科学研究センター トランスクリプトーム研究チーム客員主管研究員 オレグ・グセフ(Oleg Gusev)
砂川 玄志郎オレグ・グセフ報道担当
理化学研究所 広報室 報道担当お問い合わせフォーム
産業利用に関するお問い合わせ
お問い合わせフォーム







